



Evaluación de la reducción de la concentración de cefalexina en solución acuosa por electrocoagulación con electrodos de grafito a diferentes valores de pH inicial e intensidad de corriente aplicada
INVENTUM
Corporación Universitaria Minuto de Dios, Colombia
ISSN: 1909-2520
ISSN-e: 2590-8219
Periodicidad: Semestral
vol. 16, núm. 30, 2021
Recepción: 20 Febrero 2021
Aprobación: 31 Marzo 2021
Publicación: 20 Abril 2021

Resumen: Esta investigación se llevó a cabo para evaluar la reducción de la concentración de cefalexina (CEF), en solución acuosa por medio de electrocoagulación (EC) con electrodos de grafito como alternativa de eliminación de este contaminante en las aguas residuales. En primer lugar, se ajustó la conductividad eléctrica del agua con NaCl, lo que permitió la formación de especies de cloro activo (HOCl y OCl-). Se emplearon electrodos de grafito debido a sus características frente al desgaste del ánodo, que ocurre con los sistemas en los cuales se emplean ánodos metálicos. Se analizó el efecto del pH inicial de la solución (7 y 8) y la intensidad de corriente aplicada (1 A y 1,5 A). Para evaluar el efecto de estas variables, se implementó un diseño experimental de tipo central compuesto y la metodología de superficie de respuesta. Adicionalmente, se determinó las condiciones de las variables de estudio las cuales permiten alcanzar la mayor efectividad del proceso. Se determinó que a un nivel de pH 7 y una intensidad de 1,5 A se alcanza una remoción del 75,5 % en la concentración de cefalexina. Para un pH 8 se observa una considerable disminución del porcentaje de reducción de concentración de cefalexina, esta situación implica que la variable que presenta mayor influencia sobre la variable de respuesta es el pH de la solución acuosa.
Palabras clave: cefalexina, electrocoagulación, especies de cloro activo.
Abstract: This researchwas carried out to evaluate the reduction of cephalexin (CEF) concentration in an aqueous solution using electrocoagulation (EC) with graphite electrodes as an alternative to eliminate this pollutant in wastewater. First, the water’s electrical conductivity was adjusted with NaCl, that allows the formation of active chlorine species (HOCl and OCl-). Graphite electrodes were used due to their characteristics against anode wear, which occurs with systems in which metallic anodes are used. The effect of the initial pH of the solution (7 and 8) and the intensity of the applied current (1 A and 1,5 A) were analyzed. In order to evaluate the effect of these variables, an experimental design of a central compound type and the response surface methodology were implemented. Additionally, the conditions of the study variables that allow to achieve the greatest effectiveness of the process were determined. It was determined that at pH 7 and an intensity of 1,5 A a removal of 75,5 % is achieved in the cephalexin concentration. For pH 8, a considerable decrease in the percentage of reduction in the concentration of cephalexin is observed, this situation that implies that the variable that has the greatest influence on the response variable is the pH of the aqueous solution.
Keywords: active chlorine species, cephalexin, electrocoagulation, graphite.
Resumo: Esta pesquisa foi realizado para avaliar a redução da concentração de cefalexina (CEF) em solução aquosa por eletrocoagulação (EC) com eletrodos de grafite como alternativa para eliminação deste poluente em águas residuárias. Primeiramente, a condutividade elétrica da água foi ajustada com NaCl, o que permitiu a formação de espécies ativas de cloro (HOCl e OCl-). Eletrodos de grafite foram utilizados devido às suas características contra o desgaste anódico, que ocorre em sistemas em que são utilizados anodos metálicos. Foram analisado o efeito do pH inicial da solução (7 e 8) e da intensidade da corrente aplicada (1 A e 1,5 A). Para avaliar o efeito dessas variáveis, um projeto experimental de um tipo de composto central e a metodologia de superfície de resposta foram implementados. Além disso, foram determinadas as condições das variáveis de estudo que permitem alcançar a maior eficácia do processo. Foi determinado que a um nível de pH 7 e uma intensidades de 1,5 A uma remoção de 75,5 % é alcançada na concentração de cefalexina. Para pH 8, observa-se uma diminuição considerável no percentual de redução da concentração de cefalexina, situação que implica que a variável que mais influencia a variável resposta é o pH da solução aquosa.
Palavras-chave: cefalexina, eletrocoagulação, espécies ativas de cloro, grafite.
Evaluación de la reducción de la concentración de cefalexina en solución acuosa por electrocoagulación con electrodos de grafito a diferentes valores de pH inicial e intensidad de corriente aplicada
Resumen
Esta investigación se llevó a cabo para evaluar la reducción de la concentración de cefalexina (CEF), en solución acuosa por medio de electrocoagulación (EC) con electrodos de grafito como alternativa de eliminación de este contaminante en las aguas residuales. En primer lugar, se ajustó la conductividad eléctrica del agua con NaCl, lo que permitió la formación de especies de cloro activo (HOCl y OCl-). Se emplearon electrodos de grafito debido a sus características frente al desgaste del ánodo, que ocurre con los sistemas en los cuales se emplean ánodos metálicos. Se analizó el efecto del pH inicial de la solución (7 y 8) y la intensidad de corriente aplicada (1 A y 1,5 A). Para evaluar el efecto de estas variables, se implementó un diseño experimental de tipo central compuesto y la metodología de superficie de respuesta. Adicionalmente, se determinó las condiciones de las variables de estudio las cuales permiten alcanzar la mayor efectividad del proceso. Se determinó que a un nivel de pH 7 y una intensidad de 1,5 A se alcanza una remoción del 75,5 % en la concentración de cefalexina. Para un pH 8 se observa una considerable disminución del porcentaje de reducción de concentración de cefalexina, esta situación implica que la variable que presenta mayor influencia sobre la variable de respuesta es el pH de la solución acuosa.
Palabras clave: cefalexina, electrocoagulación, especies de cloro activo,
grafito.
I. INTRODUCCIÓN
Los productos farmacéuticos y de cuidado personal re- presentan lo que se ha denominado actualmente como contaminantes emergentes. Este tipo de sustancias no son monitoreadas de forma rutinaria en las plantas de tratamiento de aguas residuales, además, debido a sus características pueden ocasionar efectos adversos en el ambiente a largo plazo [1]. Como parte de los productos farmacéuticos de uso común en humanos y animales, se pueden mencionar los antibióticos, este tipo de sustancias son de particular interés por su potencialidad para promover resistencia en los microrganismos existentes en los cuerpos de aguas, que son los receptores de aguas residuales [2], [3]. Entre los antibióticos de uso más frecuente se encuentra la cefalexina CEF, esta pertenece a la familia de las cefalosporinas, que representan la segunda clase de antibióticos de mayor uso a nivel mundial, asimismo, se caracteriza por su alta solubilidad en agua y la presencia de un anillo β-lactámico dentro de su estructura [4]. La CEF es un antibiótico sistémico empleado para tratar enfermedades respiratorias, urinarias e infecciones ligeras en tejidos blandos causadas por bacterias [5]. La presencia de antibióticos como la CEF en los cuerpos de agua, se debe a la descarga de aguas residuales domésticas, hospitalarias y aguas residuales de la industria farmacéutica [6]. En la actualidad, los sistemas de tratamiento convencionales no presenta una adecuada eficiencia para remover compuestos tales como la CEF [7]. Debido a ello es necesario la búsqueda de alternativas que permitan eliminar o reducir la concentración de contaminantes como, por ejemplo, la CEF en las aguas residuales. Entre las distintas técnicas empleadas para la reducción de concentración de CEF en solución acuosa, se encuentra algunas como: la adsorción sobre nano partículas de carbón activado [8]; la oxidación con H2O2 en presencia de radiación solar [9]; la oxidación sonoquímica intensificada con el reactivo de Frentón [10]; la fotocatálisis con radiación solar [11], [12],[13];
tratamientos biológicos [14], [15], [16], [17] y los procesos
electroquímicos [18]. Sin embargo, actualmente no se encuentran estudios relacionados con electrocoagulación para reducción de concentración de CEF utilizando electrodos de grafito.
Para incrementar la conductividad eléctrica del agua se empleó NaCl como electrolito; además, esta sal, a lo largo del proceso electroquímico, puede promover la formación de especies oxidantes de cloro activo tales como HOCl y OCl- [19]. Aunque es necesario destacar que, resulta poco probable que dichas especies químicas puedan oxidar completamente o mineralizar la CEF debido al bajo potencial de oxidación que estas especies presentan.
El objetivo de este estudio fue investigar la reducción de concentración de la cefalexina en solución acuosa mediante electrocoagulación con electrodos de grafito, para evaluar los siguientes parámetros: pH, voltaje y tiempo de reacción, determinando la eficiencia del reactor. Los electrodos de grafito fueron seleccionados debido a su relativo bajo costo, resistencia a la corrosión, baja dilatación y baja reactividad en solución acuosa [20].
II. MATERIALES Y MÉTODOS
Para la realización de los ensayos se empleó cefalexina (monohidrato al 99 %) suministrada por una empresa farmacéutica local. El NaCl utilizado fue grado reactivo analítico (Merck Millipore), las soluciones de HCl 0,1 N y NaOH 0,1 N fueron soluciones estándar Merck Titripur, y el agua para la dilución de la cefalexina, con el fin de alcanzar la concentración deseada, fue agua ultra pura; por consiguiente, se utilizó un conductímetro HANNA HI9033 para medir un valor menor de 0,2 μS/cm. Por otro lado, los ensayos se llevaron a cabo en el montaje experimental que se detalla en la figura 1, el cual consta de cuatro electrodos de grafito de tipo amorfo, con dimensiones de 0,28 m de alto, 01 m de ancho y 0,01 m de espesor, con una densidad de 1650 mg/m3 y una porosidad del 5 %. Cabe resaltar que al finalizar cada ensayo se lavaron las placas con agua destilada para que no afectara el siguiente proceso.

El recipiente de reacción presenta hendiduras para la ubicación de los electrodos, pero permite tener 0,05 m desde el fondo hasta la parte inferior de los electrodos, con el fin de permitir el libre movimiento del agitador magnético con el cual se realizó la mezcla de la solución. La altura de los electrodos sumergidos en solución fue de 0,14 m, de modo que el área de cada electrodo en contacto con la solución fue de 0,028 m2. Los ensayos fueron realizados con base en un diseño experimental de tipo central compuesto. Las variables o factores experimentales fueron el pH inicial de la solución acuosa (7 y 8), medidos en un pH metro Metrohm 780 y la intensidad de corriente aplicada (1 A y 1,5 A), suministrado por una fuente de poder GVDA SPS-H3010, la variable de respuesta fue el porcentaje de reducción de concentración de CEF en la solución. La concentración inicial de CEF fue de 25 mg/L y de 300 mg/L de cloruro de sodio (fuerza iónica 7,5 mM), el tiempo de reacción de 1,5 horas y la velocidad de agitación 250 rpm. El montaje para los 13 ensayos fue ubicado en un lugar con ausencia de luz. Una vez terminado cada ensayo, se tomó una muestra para determinar el valor de concentración final de cefalexina en el agua, lo cual fue medido por un espectrofotómetro UV VIS Merck PHARO 300 a 261 nm [21]. Los resultados experimentales fueron analizados por medio de análisis de varianza (ANOVA), con el fin de establecer el efecto de cada factor experimental sobre la variable de respuesta y, posteriormente, se empleó la metodología conocida como superficie de respuesta (SDR) para determinar los valores de los factores o variables para los cuales se puede esperar la mayor reducción de concentración de CEF.
I. RESULTADOS Y DISCUSIÓN
Los resultados de cada uno de los ensayos se presentan en la tabla 1.
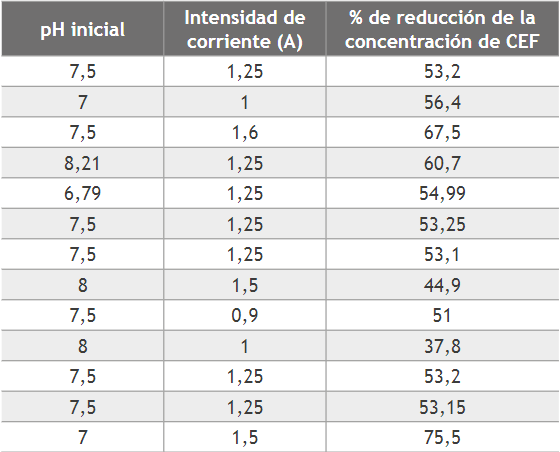
En esta tabla, se observan los valores de los factores o variables de proceso empleados en cada experimento y el porcentaje de reducción de concentración de CEF alcanzado. La reducción de concentración de CEF fue analizada en términos de porcentaje de reducción de concentración a partir de la siguiente ecuación.
 [:]
[:]En la ecuación anterior Co y Cf representan la concentración inicial y concentración final de CEF en mg/L. En la tabla 1 se observa que la reducción de concentración en todos los ensayos fue superior al 37 %, hecho que se debe tanto a las reacciones de oxidación y reducción en los electrodos, como al uso de NaCl como electrolito para incrementar la conductividad eléctrica del agua y promover la generaciónde especies de cloro activo (HOCl y OCl-). Principalmente, estas especies de cloro activo pueden reaccionar de forma no selectiva a través de diferentes mecanismos [22], además, este tipo de oxidantes electro generados no presentan la suficiente capacidad para mineralizar la CEF; de modo que estas moléculas requieren difundirse hacia la superficie del ánodo para ser oxidadas completamente por la acción de los radicales OH* [23]. Con base en estudios previos, es necesario señalar que la reducción electroquímica de CEF es mediada por la formación de especies de cloro generadas en el ánodo de acuerdo con las siguientes ecuaciones:
 [:]
[:]Por su parte el agua se oxida en el ánodo y la reacción de esta procede de acuerdo con la siguiente reacción [24]:
 [:]
[:]Además, la oxidación de compuestos orgánicos, como es el caso de la CEF, se puede representar por medio de las ecuaciones que aparecen a continuación [24]:
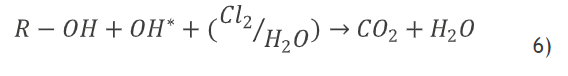 [:]
[:]De acuerdo con los resultados y con base en el valor de pH inicial de la solución, la especie de cloro activo electro generado predominante es el HOCl, este compuesto ge-neralmente ocasiona modificaciones en el compuesto con el cual reacciona, y da lugar a moléculas más oxidadas o cloradas [22]. Además, suele ocurrir que los productos
de degradación generados sean menos reactivos con las especies de cloro reactivo [25]. Con base en lo anterior, es probable que la reducción de CEF sea por causa de los efectos combinados de oxidación por el HOCl y los radicales OH* formados en el ánodo. La tabla 2 corresponde al ANOVA realizado para la superficie de respuesta del modelo de tercer orden, que presento la mejor correlación con respecto a los datos experimentales.
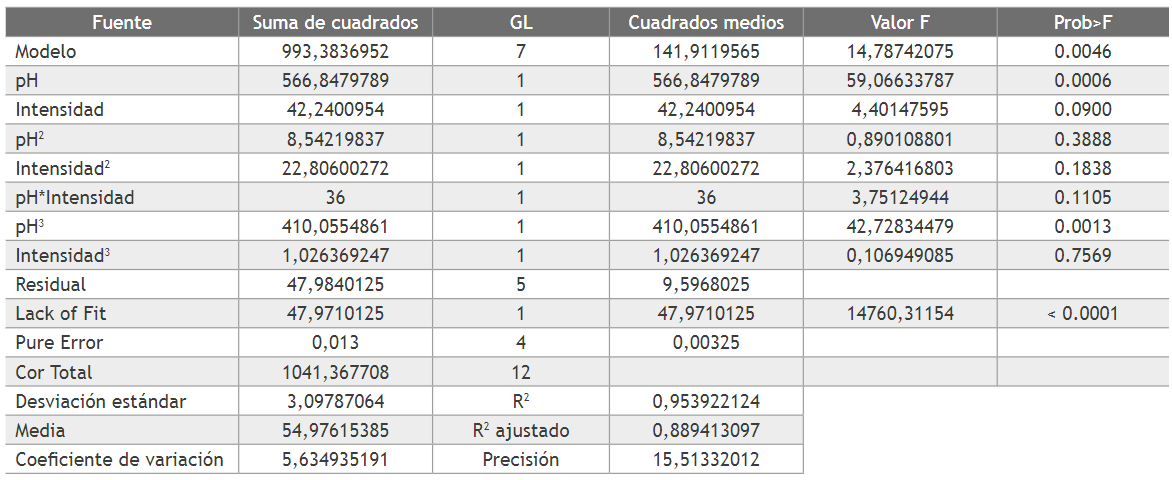
Del ANOVA se observa que tanto el pH como la interacción cubica del pH son significativas e influyen en el valor de la variable de respuesta. La intensidad de corriente no presenta una influencia significativa sobre la remoción de CEF para el rango de valores de esta variable, que fue empleado en los ensayos. El valor de la correlación (R2) y la precisión indican que el modelo obtenido por el ANOVA para la superficie de respuesta permite analizar adecuadamente los datos en el espacio de diseño del experimento. La superficie de respuesta obtenida para los resultados experimentales se presenta en la figura 2.
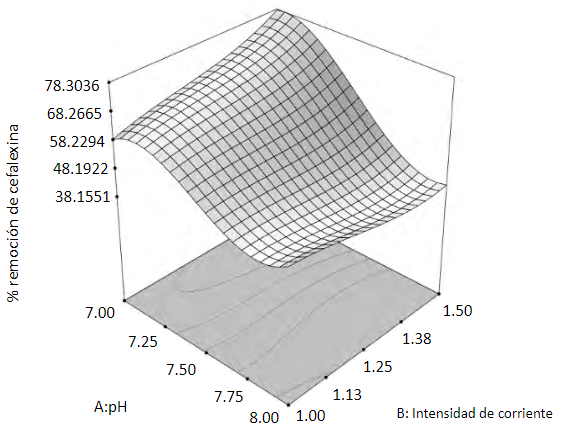
La SDR permite observar que la reducción de concentración de CEF depende del pH inicial de la solución y alcanza mayores valores a pH neutro. Por otra parte, la influencia de la intensidad de corriente es positiva, de modo que, al aumentar el valor de esta variable a pH inicial de 7, se nota el incremento en la variable de respuesta. El efecto de la intensidad de corriente aplicada se reduce al aumentar el pH, hecho que puede ser explicado por el equilibrio del HOCl,para el cual a pH alcalino predomina el OCl- en la solución, y este ion presenta menor fuerza oxidante que el HOCl. Esta situación denota la influencia de la formación de especies de cloro activo para lograr la reducción de concentración de CEF en solución acuosa. La optimización realizada a partir de la SDR permite indicar que a pH inicial igual a 7, hay una intensidad de corriente aplicada de 1.5 A y con 1,5 h de reacción se alcanza un 78 % de reducción de la concentración de CEF para una densidad de corriente de 53,57 A/m2.
I.V CONCLUSIONES
El proceso de EC para la reducción de la concentración de CEF en solución acuosa representa una alternativa atractiva debido a su fácil operación, un relativo corto tiempo de reacción y bajo consumo de productos químicos adicionales. Además al no introducir iones metálicos a la solución por efecto de la oxidación del ánodo, puesto que se emplearon electrodos de grafito y NaCl como electrolito para la formación de especies de cloro reactivo, esto tuvo una aportación al proceso de reducción de concentración de cefalexina, en solución acuosa. Para las condiciones analizadas, la mayor reducción de concentración de CEF alcanza un valor máximo del 75,5 %, con un pH inicial de la solución acuosa igual a 7 y 1,5 A de intensidad de corriente aplicada en 90 minutos de reacción, este último valor se puede considerar razonable para una aplicación a escala real. La variable o factor de proceso que presenta mayor efecto sobre la reducción de concentración de CEF es el pH inicial de la solución. La razón para esta situación es que el pH afecta el equilibrio entre las especies de cloro reactivo, a pH neutro y ligeramente ácido la especie predominante es el HOCl, reconocido por ser un agente oxidante más fuerte que el ion OCl-. Por otra parte, el pH influye en las reacciones de la formación de radicales OH* en el ánodo. De manera que, la reducción de la concentración de CEF se debe al efecto combinado de las especies de cloro reactivo y los radicales OH*. Con respecto a los electrodos, la porosidad del grafito y su inercia ante las reacciones electroquímicas hacen de este una opción por considerar para este tipo de sistemas de tratamiento.
II. REFERENCIAS
[1] H. Kaur, G. Hippargi, G. R. Pophali, y A. K. Bansiwal, “Treatment methods for removal of pharmaceuticals and personal care products from domestic wastewater”, Pharmaceuticals and Personal Care Products: Waste Management and Treatment Technology, (pp. 129–150). Elsevier, 2019. doi: 10.1016/B978-0-12-816189-0.00006-8
[2] H. W. Leung, T. B. Minh, M. B. Murphy, J. C Lam, M. K. So, M. Martin, P. K Lam, y B. J. Richardson, “Distribution, fate and risk assessment of antibiotics in sewage treatment plants in Hong Kong, South China”, Environ. Int., vol. 42, no. 1, pp. 1–9, 2012. doi: 10.1016/j.envint.2011.03.004.
[3] V. Homem, y L. Santos, “Degradation and removal methods of antibiotics from aqueous matrices - A review”, J. Environ. Manage., vol. 92, no. 10, pp. 2304–2347, 2011. doi: 10.1016/j. jenvman.2011.05.023.
[4] L. A. Perea, R. E. Palma-Goyes, J. Vazquez-Arenas, I. Romero-Ibarra, C. Ostos, and R. A. Torres-Palma, “Efficient cephalexin degradation using active chlorine produced on ruthenium and iridium oxide anodes: Role of bath composition, analysis of degradation pathways and degradation extent”, Sci. Total Environ., vol. 648, pp. 377–387, 2019. doi: 10.1016/j.scitotenv.2018.08.148.
[5] C. Su, X. Lin, P. Zheng, Y. Chen, L. Zhao, Y. Liao, y J. Liu, “Effect of cephalexin after heterogeneous Fenton-like pretreatment on the performance of anaerobic granular sludge and activated sludge”, Chemosphere, vol. 235, pp. 84–95, 2019. doi: 10.1016/j.chemosphere.2019.06.136.
[6] J. Xu, Y. Li, M. Qian, J. Pan, J. Ding, y B. Guan, “Amino-functionalized synthesis of MnO2-NH2- GO for catalytic ozonation of cephalexin”, Appl. Catal. B Environ., vol. 256, p. 117797, 2019. doi: 10.1016/j.apcatb.2019.117797.
[7] A. Almasi, R. Esmaeilpoor, H. Hoseini, V. Abtin, y M. Mohammadi, “Photocatalytic degradation of cephalexin by UV activated persulfate and Fenton in synthetic wastewater: optimization, kinetic study, reaction pathway and intermediate products”, J. Environ. Heal. Sci. Eng., vol. 18, no. 2, pp. 1359-1373, 2020. doi: 10.1007/s40201-020- 00553-1.
[8] H. R. Pouretedal, y N. Sadegh, “Effective removal of Amoxicillin, Cephalexin, Tetracycline and Penicillin G from aqueous solutions using activated carbon nanoparticles prepared from vine wood”, J. Water Process Eng., vol. 1, pp. 64–73, 2014, doi: 10.1016/j.jwpe.2014.03.006.
[9] R. S. C. Sierra, H. Zúñiga-Benítez, y G. A. Peñuela, “Experimental data on antibiotic cephalexin removal using hydrogen peroxide and simulated sunlight radiation at lab scale: Effects of pH and H2O2”, Data Brief, vol. 30, p. 105437, 2020, doi: 10.1016/j.dib.2020.105437.
[10] T. J. Al-Musawi, H. Kamani, E. Bazrafshan, A. H. Panahi, M. F. Silva, y G. Abi, “Optimization the Effects of Physicochemical Parameters on the Degradation of Cephalexin in Sono-Fenton Reactor by Using Box-Behnken Response Surface Methodology”, Catal. Letters, vol. 149, pp. 1186– 1196, 2019, doi: 10.1007/s10562-019-02713-x.
[11] N. Li, Y. Tian, J. Zhao, J. Zhang, W. Zou, L. Kong, y H. Cui, “Z-scheme 2D/3D g-C3N4@ZnO with enhanced photocatalytic activity for cephalexin oxidation under solar light”, Chem. Eng. J., vol. 352, no. 15, pp. 412–422, 2018, doi: 10.1016/j. cej.2018.07.038.
[12] M. Aram, M. Farhadian, A. R. Solaimany Nazar, S. Tangestaninejad, P. Eskandari, y B. H. Jeon, “Metronidazole and Cephalexin degradation by using of Urea/TiO2/ZnFe2O4/Clinoptiloite catalyst under visible-light irradiation and ozone injection”, J. Mol. Liq., vol. 304, no. 15, p. 112764, 2020, doi: 10.1016/j.molliq.2020.112764.
[13] J. He, Y. Zhang, Y. Guo, G. Rhodes, J. Yeom, H. Li, y W. Zhang, “Photocatalytic degradation of cephalexin by ZnO nanowires under simulated sunlight: Kinetics, influencing factors, and mechanisms”, Environ. Int., vol. 132, no. April, p. 105105, 2019, doi: 10.1016/j.envint.2019.105105.
[14] B. Wang, H. Li, T. Liu, y J. Guo, “Enhanced removal of cephalexin and sulfadiazine in nitrifying membrane-aerated biofilm reactors”, Chemosphere, vol. 263, p. 128224, 2021, doi: 10.1016/j.chemosphere.2020.128224.
[15] A. A. Al-Gheethi, A. N. Efaq, R. M. Mohamed, I. Norli, y M. O. Kadir, “Potential of bacterial consortium for removal of cephalexin from aqueous solution”, J. Assoc. Arab Univ. Basic Appl. Sci., vol. 24, no. 1, pp. 141–148, 2017, doi: 10.1016/j. jaubas.2016.09.002.
[16] G. Rhodes, Y. H. Chuang, R. Hammerschmidt, W. Zhang, S. A. Boyd, y H. Li, “Uptake of cephalexin by lettuce, celery, and radish from water,”, Chemosphere, vol. 263, p. 127916, 2021, doi: 10.1016/j.chemosphere.2020.127916.
[17] E. Angulo, L. Bula, I. Mercado, A. Montaño, y N. Cubillán, “Bioremediation of Cephalexin with non- living Chlorella sp., biomass after lipid extraction”, Bioresour. Technol., vol. 257, pp. 17–22, 2017, 2018, doi: 10.1016/j.biortech.2018.02.079.
[18] M. Leili, N. Shirmohammadi Khorram, K. Godini, G. Azarian, R. Moussavi, y A. Peykhoshian, “Application of central composite design (CCD) for optimization of cephalexin antibiotic removal using electro-oxidation process”, J. Mol. Liq., vol. 313, no. 1, p. 113556, 2020, doi: 10.1016/j. molliq.2020.113556.
[19] J. M. Aquino, M. A. Rodrigo, R. C. Rocha-Filho, C. Sáez, y P. Cañizares, “Influence of the supporting electrolyte on the electrolyses of dyes with conductive-diamond anodes”, Chem. Eng. J., vol. 184, no. 1, pp. 221–227, 2012, doi: 10.1016/j. cej.2012.01.044.
[20] G. C. C. Yang, Y. C. Chen, H. X. Yang, y C. H. Yen, “Performance and mechanisms for the removal of phthalates and pharmaceuticals from aqueous solution by graphene-containing ceramic composite tubular membrane coupled with the simultaneous electrocoagulation and electrofiltration process”, Chemosphere, vol. 155, pp. 274–282, 2016, doi: 10.1016/j.chemosphere.2016.04.060.
[21] Y. Rashtbari, S. Hazrati, S. Afshin, M. Fazlzadeh, y M. Vosoughi, “Data on cephalexin removal using powdered activated carbon (PPAC) derived from pomegranate peel”, Data Brief, vol. 20, pp. 1434– 1439, 2018, doi: 10.1016/j.dib.2018.08.204.
[22] M. Deborde, y U. von Gunten, “Reactions of chlorine with inorganic and organic compounds during water treatment-Kinetics and mechanisms: A critical review”, Water Research, vol. 42, no. 1–2, pp. 13–51, 2008, doi: 10.1016/j.watres.2007.07.025.
[23] D. A. C. Coledam, M. M. S. Pupo, B. F. Silva, A. J. Silva, K. I. B. Eguiluz, G. R. Salazar-Banda, y J. M. Aquino, “Electrochemical mineralization of cephalexin using a conductive diamond anode: A mechanistic and toxicity investigation”, Chemosphere, vol. 168, pp. 638–647, 2017, doi: 10.1016/j.chemosphere.2016.11.013.
[24] N. Nageswara Rao, M. Rohit, G. Nitin, P. N. Parameswaran, y J. K. Astik, “Kinetics of electrooxidation of landfill leachate in a three- dimensional carbon bed electrochemical reactor”, Chemosphere, vol. 76, no. 9, pp. 1206–1212, 2009, doi: 10.1016/j.chemosphere.2009.06.009.
[25] A. L. Giraldo Aguirre, E. D. Erazo Erazo, O. A. Flórez Acosta, E. A. Serna Galvis, y R. A. Torres Palma, “Tratamiento electroquímico de aguas que contienen antibióticos β-lactámicos”, Cienc. E Desarro., vol. 7, no. 1, pp. 21–29, 2016, doi: 10.19053/01217488.4227.

