



Estudio comparativo del comportamiento de algunas pectinas comerciales como inhibidores en la formación de hidratos de tetrahidrofurano
INVENTUM
Corporación Universitaria Minuto de Dios, Colombia
ISSN: 1909-2520
ISSN-e: 2590-8219
Periodicidad: Semestral
vol. 15, núm. 28, 2020
Recepción: 10 Enero 2020
Aprobación: 31 Marzo 2020
Publicación: 30 Mayo 2020
Resumen: En esta investigación se evaluó el uso de pectinas comerciales como inhibidores en la formación de hidratos de tetrahidrofurano, en busca de aquellas que se comportaran de acuerdo con la premisa básica de un inhibidor cinético, para disminuir la velocidad de la inducción o retrasar la formación y crecimiento de los cristales de hidrato. Utilizando 20% v/v como la proporción más adecuada de tetrahidrofurano y variando el tipo y concentración de pectina, se realizó el enfriamiento paulatino de la solución formadora de hidratos. Se encontró que con una concentración de 0,1% de pectina de frutos cítricos esterificada y con 0,5% de pectina de frutos cítricos esterificada con sal de potasio se registraron los mayores tiempos para el periodo de inducción, y con la utilización de una concentración de 0,1% de pectina de frutos cítricos de bajo índice de metoxilo se registró el mayor tiempo para el periodo de crecimiento. Al final, todos los experimentos realizados terminaron con la aglomeración de los cristales de hidrato. Aquellas pectinas comerciales que mostraron resultados positivos como inhibidores en la formación de hidratos de tetrahidrofurano podrían también tener el potencial de inhibir la formación de hidratos de gas natural.
Palabras clave: gas natural, hidratos, inhibidores, pectinas, tetrahidro- furano.
Abstract: In this research, the use of commercial pectins as inhibitors in the formation of tetrahydrofuran hydrates was evaluated, looking for those that behaved according to the basic premise of a kinetic inhibitor, to slow down induction or delay hydrate crystal formation and growth. Using 20% v / v as the most adequate proportion of tetrahydrofuran and varying the type and concentration of pectin, the gradual cooling of the hydrate-forming solution was carried out. It was found that with a concentration of 0.1% citrus pectin esterified and 0.5% citrus pectin esterified with potassium salt, the longest times were recorded for the induction period, and with the use of a concentration of 0.1% pectin from citrus fruits with low methoxyl index was recorded the longest time for the growth period. In the end, all the experiments carried out ended with the agglomeration of the hydrate crystals. Those commercial pectins that showed positive results as inhibitors in tetrahydrofuran hydrate formation may also have the potential to inhibit natural gas hydrate formation.
Keywords: natural gas, hydrates, inhibitors, pectins, tetrahydrofuran.
Resumo: Nesta pesquisa foi avaliada a utilização de pectinas comerciais como inibidores na formação de hidratos de tetrahidrofurano, em busca daqueles que se comportassem de acordo com a premissa básica de um inibidor cinético, para retardar a indução ou retardar a formação e o crescimento de cristais de hidrato. Usando 20% v / v como a proporção mais adequada de tetrahidrofurano e variando o tipo e concentração de pectina, foi realizado o resfriamento gradual da solução formadora de hidrato. Verificou-se que com a concentração de 0,1% de pectina de citrinos esterificada e com 0,5% de pectina de citrino esterificada com sal de potássio, os maiores tempos foram registrados para o período de indução, e com o uso de um A concentração de 0,1% de pectina de frutas cítricas com baixo índice de metoxila foi registrada pelo maior tempo para o período de crescimento. Ao final, todos os experimentos realizados terminaram com a aglomeração dos cristais de hidrato. As pectinas comerciais que apresentaram resultados positivos como inibidores da formação de hidratos de tetrahidrofurano também podem ter o potencial de inibir a formação de hidratos de gás natural.
Palavras-chave: gás natural, hidratos, inibidores, pectinas, tetrahidrofurano.
Estudio comparativo del comportamiento de algunas pectinas comerciales como inhibidores en la formación de hidratos de tetrahidrofurano
Resumen
En esta investigación se evaluó el uso de pectinas comerciales como inhibidores en la formación de hidratos de tetrahidrofurano, en busca de aquellas que se comportaran de acuerdo con la premisa básica de un inhibidor cinético, para disminuir la velocidad de la inducción o retrasar la formación y crecimiento de los cristales de hidrato. Utilizando 20% v/v como la proporción más adecuada de tetrahidrofurano y variando el tipo y concentración de pectina, se realizó el enfriamiento paulatino de la solución formadora de hidratos. Se encontró que con una concentración de 0,1% de pectina de frutos cítricos esterificada y con 0,5% de pectina de frutos cítricos esterificada con sal de potasio se registraron los mayores tiempos para el periodo de inducción, y con la utilización de una concentración de 0,1% de pectina de frutos cítricos de bajo índice de metoxilo se registró el mayor tiempo para el periodo de crecimiento. Al final, todos los experimentos realizados terminaron con la aglomeración de los cristales de hidrato. Aquellas pectinas comerciales que mostraron resultados positivos como inhibidores en la formación de hidratos de tetrahidrofurano podrían también tener el potencial de inhibir la formación de hidratos de gas natural.
Palabras clave: gas natural, hidratos, inhibidores, pectinas, tetrahidrofurano.
I. INTRODUCCIÓN
Los hidratos de gas natural han sido considerados de gran interés por su potencial como fuente de energía no convencional, debido a las grandes can tidades estimadas de hidratos de metano que hay en las profundidades de los océanos tropicales y el permafrost ártico, y como un medio de almacenamiento y transporte de gas natural, ya que un volumen grande de gas metano puede ser atrapado dentro de las cavidades de los hidratos [1], [2], [3], [4] y [5].
Por otro lado, la formación de hidratos de gas en las instalaciones de procesamiento y tuberías por mucho tiempo ha sido un inconveniente para la industria del gas natural. Tanto si el problema se produce en el transporte o el procesamiento, la formación de hidratos puede causar obstrucción de las tuberías, lo que ocasiona paradas de planta e incluso la destrucción de valiosos equipos [6], [7].
Para que haya formación de hidratos de gas se requiere la presencia de un formador de hidratos como el metano, agua y una combinación de altas presiones o bajas temperaturas. Por lo tanto, las estrategias para su mitigación y remediación a menudo requieren modificar una o más de estas condiciones para desestabilizar el hidrato. Sin embargo, los hidratos de gas también pueden prevenirse mediante la inyección de inhibidores químicos que tienen por objeto modificar la termodinámica o la cinética de formación del hidrato [8], [9] y [10].
El aseguramiento de flujo es un término relativamente nuevo en la industria del petróleo y del gas, y tiene por finalidad asegurar el éxito económico y el flujo de hidrocarburos desde su origen hasta el punto de venta, al considerar la predicción y disminución de fenómenos (como la formación de hidratos) que pueden afectar el transporte continuo y eficiente de estos fluidos. Por consiguiente, el uso
de pectinas puede convertirse en una alternativa viable para la remediación de los problemas asociados con la formación de hidratos en esta industria [6], [11].
II. REVISIÓN DEL ESTADO DEL ARTE
Los hidratos de gas son compuestos de inclusión o clatratos, complejos cristalinos formados por la combinación física de agua y compuestos de bajo peso molecular, que típicamente son gases a condiciones ambientales. Tienen como fórmula general Mn(H2Op, donde una o más moléculas formadoras de hidratos M denominadas “huésped” se asocian con p moléculas de agua. Su formación no está ligada a ninguna relación estequiométrica definida, pero sí al tipo de “huésped” y a las condiciones de presión y temperatura presentes. Las moléculas de gas son físicamente encerradas en los intersticios y cavidades dentro de la estructura de la red formada por las moléculas de agua que se enlazan entre sí mediante puentes de hidrógeno [12], [2], [13].
Esta red cristalina sola es termodinámicamente inestable. La inclusión de moléculas de gas no polares estabiliza la estructura mediante fuerzas de Van der Waals, por lo tanto, pueden formarse hidratos a temperaturas por encima del punto de congelación del agua líquida [14], [15].
Los hidratos de gas comprenden aproximadamente 85% mol de agua y 15% mol de “huésped”. La gran concentración de ambas moléculas en la fase hidrato resulta en el crecimiento de cristales en la interfase gas – líquido [16], [17].
Existen tres diferentes tipos de hidratos clatratos cuyas estructuras cristalinas están asociadas con el tamaño de la molécula huésped: estructura cúbica I (sI), estructura cúbica II (sII) y estructura hexagonal H (sH) (Figura 1) [18], [13].
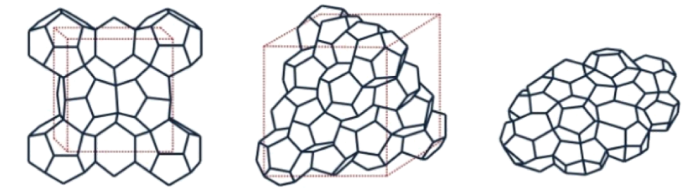
Los hidratos de estructura tipo sI tienen dos tipos de cavidad, una pequeña cavidad dodecaédrica pentagonal que consta de 12 anillos pentagonales de agua (20 moléculas de agua), es decir que la cavidad tiene 12 caras de 5 lados: 512; y una gran cavidad tetracaidecaedral que consta de 12 anillos pentagonales y 2 hexagonales de agua (24 moléculas de agua), es decir que la cavidad tiene 12 caras de 5 lados unidas con 2 caras de 6 lados: 51262 [19] y [13].
Los hidratos tipo sI conforman una estructura cúbica con moléculas de gas más pequeñas que el propano, como metano, dióxido de carbono y sulfuro de hidrógeno. El número total de cavidades en la estructura es 8 (2 pequeñas y 6 grandes) [15].
Los hidratos de estructura tipo sII también tienen dos tamaños de cavidad, la cavidad dodecaédrica pentagonal: 512, y una cavidad grande hexacaidecaedral que consta de 12 anillos pentagonales y 4 hexagonales de agua (28 moléculas de agua), es decir que la cavidad tiene 12 caras de 5 lados unidas con 4 caras de 6 lados: 51264 [19], [13].
Los hidratos tipo sII conforman una estructura cúbica con moléculas de gas más grandes que el etano y más pequeñas que el pentano, como acetona, benceno y tetrahidrofurano. El número total de cavidades en la estructura es 24 (16 pequeñas y 8 grandes) [15], [20].
A diferencia de los hidratos de estructura tipo sI y sII, los hidratos de estructura tipo sH tienen tres tipos de cavidad, la cavidad más pequeña: 512, la cavidad media: 435663 y la cavidad más grande: 51268. También hay que señalar que los hidratos tipo sH no pueden estar formados por una sola especie de hidrocarburo, por lo menos dos componentes huésped deben estar presentes. Uno de ellos debe ser de un tamaño molecular relativamente grande (como el metilciclohexano), que desempeña el papel básico de formador de hidratos tipo sH, mientras que el otro componente debe tener un tamaño molecular relativamente pequeño (como el metano o el nitrógeno) [11], [20].
La cinética de formación de hidratos está dividida en tres etapas principales: inducción, crecimiento y finalmente disociación de los hidratos [11], [21].
La nucleación de los hidratos, que también suele llamarse periodo de inducción, es el proceso donde pequeños núcleos cristalinos de hidrato crecen y se dispersan hasta que alcanzan un tamaño crítico para el crecimiento continuo. Existen dos tipos de
nucleación, homogénea y heterogénea. La nucleación homogénea es un proceso de solidificación que ocurre en los sistemas sin impurezas. En realidad, la nucleación casi siempre es heterogénea, ya que es casi imposible no tener presencia de partículas extrañas. La presencia de partículas extrañas reduce la cantidad de energía requerida para formar un núcleo estable [8] y [22].
El crecimiento de los hidratos se refiere al crecimiento de núcleos de hidrato estables como cristales sólidos después de alcanzar el tamaño crítico. Los mismos factores que afectan la nucleación, junto con la transferencia de calor y masa, también afectan el crecimiento de los hidratos [8] y [17].
El proceso de disociación es considerado como un proceso endotérmico que produce agua y el gas que estaba encerrado dentro de la estructura del hidrato. La disociación de los hidratos consiste en la destrucción de la estructura del hidrato, la desorción de la molécula huésped de la superficie y la difusión del gas [8] y [23].
En la detección de la formación y disociación de hidratos se han obtenido resultados donde se han utilizado patrones de conductividad eléctrica para determinar las tendencias de las variaciones en la formación y disociación de los hidratos. La conductividad eléctrica sufre variaciones a medida que transcurre el tiempo y disminuye la temperatura, debido a que a medida que esta decrece, las moléculas se van uniendo formando sólidos, dando como consecuencia la imposibilidad de flujo de electrones a través del material (disminución de la conductividad) y posteriormente la formación de hidratos [24] y [6].
La formación de hidratos de gas en una tubería puede darse de dos maneras: como consecuencia de un enfriamiento lento del fluido, como en una tubería que alcanza las condiciones de presión y temperatura adecuadas para la formación de hidratos, o por un rápido enfriamiento causado por la disminución de la presión en las válvulas o un cambio en el diámetro del tubo. Los hidratos comenzarán a formarse en las paredes de las tuberías, lo cual afectará el aseguramiento de flujo, lo que causa graves consecuencias operacionales [6].
La formación de hidratos de metano se favorece a bajas temperaturas, entre 275 y 285 K aproximadamente y a altas presiones, las cuales pueden ir desde 2,5 hasta 11 MPa. A medida que la presión aumenta, la temperatura de formación también aumenta. La presencia de hidrocarburos
livianos y de agua libre, así como altas velocidades de gas y la agitación, lo que permite un incremento del área interfacial entre el gas y el agua, también favorecen la formación de hidratos [25].
En general, los hidratos se forman en el laboratorio a partir de sistemas de dos fases por contacto de uno o varios formadores de hidratos en fase líquida o gaseosa con agua líquida y aumentando la presión hasta que se forme el hidrato [7].
Tanto los experimentos como la teoría han demostrado que los hidratos pueden formarse a partir de un sistema de una sola fase que consiste de agua líquida con un formador de hidratos disuelto bajo las condiciones apropiadas de temperatura, presión, y contenido del formador de hidratos. En estas condiciones, la presión requerida para la formación de hidratos será igual o mayor que la requerida para separar la fase gaseosa o líquida del formador de hidratos presente [7].El tetrahidrofurano (C4H8O) se ha usado por mucho tiempo como sustituto para el metano (CH4) en los estudios de laboratorio (Figura 2) [26]
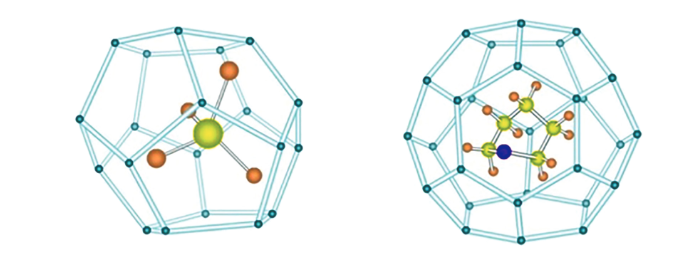
La principal ventaja que tiene el tetrahidrofurano (THF) con respecto al metano es su completa miscibilidad en agua, lo cual permite con relativa rapidez, la síntesis homogénea de hidratos de THF en sedimentos y un estricto control de la frac ción volumétrica del hidrato. Los hidratos de THF (C5H10O·17H2O), a diferencia de los hidratos de metano (CH4·6H2O), también tienen la ventaja de ser estables a presión atmosférica. Y finalmente, porque los hidratos de THF no se disocian a una fase gseosa con las complicaciones asociadas [12] y [26].
Hay varias opciones para prevenir la formación de hidratos. Estas opciones incluyen calefacción, aislamiento, eliminación de agua, y el uso de inhibidores de hidratos [6].
La tecnología actual adoptada por las industrias del petróleo y el gas para prevenir la formación de hidratos de gas en las tuberías consiste en la introducción de un inhibidor termodinámico. La adición de una cantidad suficiente de estos compuestos desplaza las condiciones requeridas para la formación de hidratos a temperaturas más bajas y/o presiones más altas [19].
Una tecnología alternativa se centra en el desarrollo de sustancias químicas de bajas dosis, tales como los inhibidores cinéticos o antiaglomerantes. Estos compuestos retardan la formación de hidratos a tiempos más largos que el tiempo de residencia del gas dentro de la sección de tubería propensa a hidratos [19] y [27].
Actualmente se ha estado estudiando la efectividad de la pectina como un inhibidor no convencional para prevenir la formación de hidratos con el fin de mejorar los procesos de transporte de gas y salvaguardar los equipos de proceso de posibles obstrucciones formadas. Además, resulta financieramente atractivo obtener la pectina con el uso de tecnologías de bajo impacto ambiental y con una inversión menor de recursos, a partir de desechos de la industria de alimentos, para obtener un producto de alto valor agregado [11].
Las pectinas son heteropolisacáridos que se presentan en la naturaleza como elementos estructurales del sistema celular de las plantas. Su componente principal es el ácido poligalacturónico, que existe parcialmente esterificado con
Estructura básica de la pectina
del líquido. La pectina es hidrofílica debido al gran número de grupos hidroxilo polares y grupos carboxilo cargados en la molécula (Figura 3) [28], [29].
Cuando la pectina se dispersa en agua, algunos de los grupos ácidos se ionizan y el agua se une tanto a los grupos cargados como a los grupos polares. De esta manera, la disponibilidad del agua es menor y la acción inhibidora de la pectina se evidencia modificando la cinética de formación del hidrato [29].
Las pectinas se obtienen de materiales vegetales que tienen un alto contenido de estas, tales como manzanas, frutas cítricas, piña, guayaba, tomate de árbol, maracuyá y remolacha. Para fines industriales, la fuente de obtención se restringe principalmente a las cáscaras de frutos cítricos, que contienen cerca del 25% de sustancias pécticas, y del bagazo de manzana, con un rendimiento alrededor
del 15% - 18% de pectina. Otras fuentes de pectina incluyen cáscaras de mango, residuos de girasol, entre otros [28].
III. DESARROLLO EXPERIMENTAL
A. Descripción del equipo
El equipo utilizado para el presente estudio es una unidad de refrigeración marca B. Braun, modelo Frigomix 1495, que está constituido por una recámara donde se almacena una mezcla de etilenglicol - agua 50% v/v que funciona como medio de enfriamiento, un termómetro y un conductímetro digital marca Thermo modelo RL060C (Figura 4).

En la parte superior del equipo se encuentra un controlador que permite fijar la temperatura, la cual ha de ajustarse en – 10 °C, lo que permite que el equipo se estabilice en aproximadamente una hora. Mediante una manguera se hace recircular el fluido refrigerante a través de la sección exterior del enfriador, conformado por un recipiente de vidrio de doble pared, con una capacidad de ~ 85 mL, donde se ha de alojar la solución formadora de hidratos.
B. Diseño experimental
Para el desarrollo de la fase experimental se identificaron las variables de mayor trascendencia para el estudio de los hidratos de THF: proporción de THF, tipo de pectina y concentración de ella para la inhibición en la formación y la disociación de los hidratos.
Para la determinación de la proporción más adecuada de THF requerida para la formación de hidratos se realizaron dos ensayos, fijando la concentración de THF en 20% y 80% v/v.
Para determinar los tipos de pectina y su concentración requerida para inhibir más eficientemente la formación de hidratos de THF se manejó un diseño de bloques aleatorizado.
Las pectinas utilizadas corresponden a pectinas comerciales suministradas por la casa distribuidora de la marca Sigma-Aldrich:
A. Pectina de manzana de bajo índice de metoxilo
B. Pectina de frutos cítricos de bajo índice de metoxilo
C. Pectina de manzana
D. Pectina de frutos cítricos esterificada
E. Pectina de frutos cítricos esterificada con sal de potasio
F. Pectinasa de Aspergillus niger
La pectina en polvo se disolvió en agua caliente y con agitación formando una solución homogénea que luego fue agregada a la solución formadora de hidratos; el agua de disolución se tomó como parte del sistema agua - THF.
Las concentraciones que se manejaron fueron las siguientes: 0,1; 0,5; 0,8 y 1,0% en peso, siendo el
valor máximo establecido el correspondiente a la máxima concentración que suele utilizarse para los inhibidores cinéticos. De esta manera, se realizaron veinticuatro ensayos distribuidos así: el experimento A tiene constante el tipo de pectina (pectina de manzana de bajo índice de metoxilo) y la variable en estudio es la concentración (0,1; 0,5; 0,8 y 1,0%). Igualmente sucede con los expe rimentos B, C, D, E y F.
Para estudiar las condiciones de una posible disociación de los hidratos de THF se realizaron dos ensayos, y se escogió el tipo de pectina y su concentración de acuerdo con los resultados que se obtuvieron anteriormente: tiempo de inducción más prolongado, periodo más largo de crecimiento y tiempo total de formación del hidrato. La pectina, disuelta previamente en agua caliente, se agregó 3 minutos después de la etapa de inducción; para el agua de disolución se tomó un volumen equivalente al 10% de la solución formadora de hidratos.
La temperatura y la conductividad eléctrica se midieron cada 30 segundos en cada uno de los experimentos realizados. Además, los ensayos que lo requirieron se realizaron por duplicado para garantizar la reproducibilidad de los experimentos.
La incertidumbre absoluta asociada a las medidas tomadas está dada por las especificaciones del conductímetro digital y corresponde a ± 2 μS/ cm para los valores de conductividad eléctrica y ± 0,05 °C para los valores de temperatura.
IV. RESULTADOS
A. Hidratos a partir de agua destilada - THF
Los hidratos de THF (C5H10O·17H2O) se formaron con la mezcla de THF y agua destilada en una relación molar 1:17, que produce la composición molar estequiométricamente correcta, para obtener hidratos de estructura tipo sII. Teniendo en cuenta esta relación, los pesos moleculares y las densidades individuales de cada sustancia, se determinó que la composición de la solución de THF debía ser 20% v/v.
Durante la formación de los hidratos se manifestaron cambios visuales importantes. Al inicio del periodo de inducción, la solución formadora de hi dratos pudo verse como un líquido transparente y homogéneo. A medida que transcurrió el tiempo,
se observó la aparición de pequeños cristales que se fueron depositando en la parte inferior del recipiente. Y posteriormente, al final del periodo
de crecimiento, apareció una masa opaca y compacta que ocupó todo el volumen del recipiente (Figura 5).

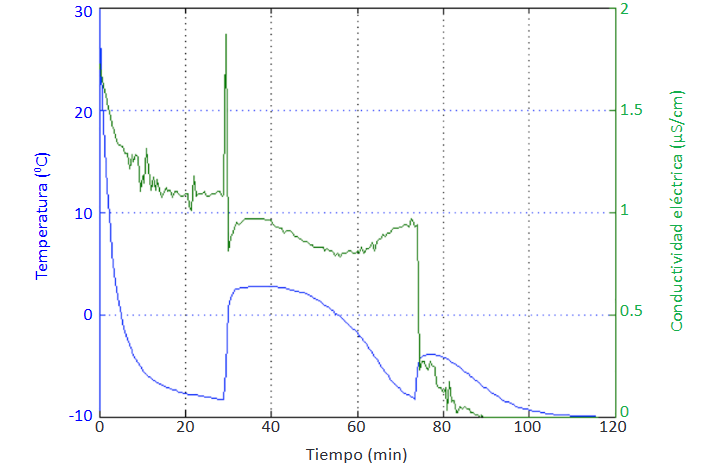
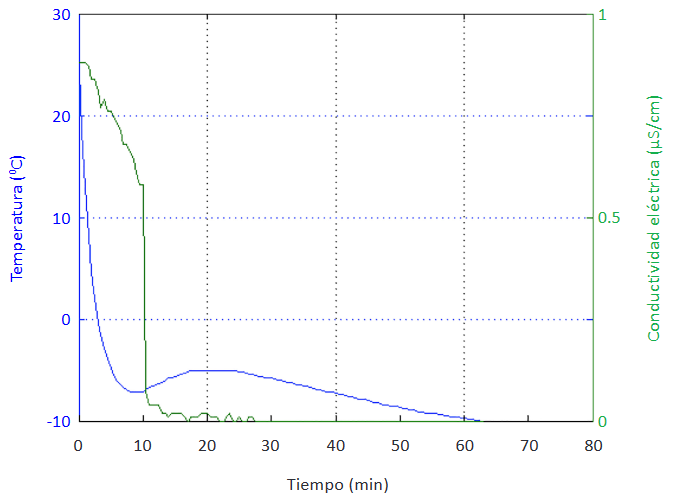
Cuando se formaron hidratos a partir de soluciones de THF al 20% v/v se pudo distinguir con claridad cada una de las etapas de formación del hidrato, el periodo de inducción y de crecimiento, mediante el análisis de las variaciones tanto de temperatura
como de conductividad eléctrica (Figura 6). Por todo lo anterior, se estableció que esta fue la proporción más adecuada de THF para la realización de las posteriores experiencias con respecto a la formación de hidratos y el uso de inhibidores.
Cuando se formaron hidratos a partir de soluciones de THF al 80% v/v, donde el agua es el componente minoritario (como sucede con los hidratos de metano), no se observaron los cambios en
las curvas de temperatura y conductividad eléctrica que corresponden a los periodos de formación del hidrato, esto debido al exceso de THF (Figura 7).
B. Formación de hidratos de THF en presencia de pectina y comparación de resultados
Una de las opciones conocidas para evitar la formación de hidratos es el uso de inhibidores químicos, los cuales tienen por objeto modificar la termodinámica o la cinética de formación del hidrato [10], [<30]. De acuerdo con lo anterior, mediante la adición de concentraciones relativamente bajas de pectina durante la formación de hidratos de THF, se procuró que esta se comportara de acuerdo con la premisa básica de un inhibidor cinético: influir en el tiempo de inducción, en la cristalización de los hidratos, la tasa de crecimiento de los cristales separados de hidrato o la aglomeración de estos cristales.
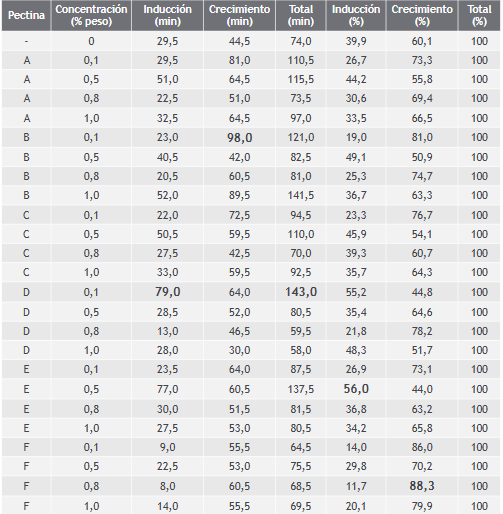
De acuerdo con el diseño experimental planteado, se compararon los resultados obtenidos al agregar cada tipo de pectina en diferentes concentraciones a la solución formadora de hidratos, teniendo en cuenta el tiempo de inducción más prolongado, el periodo más largo de crecimiento y el tiempo total de formación del hidrato. Los tiempos relativos dados por la fracción de tiempo correspondiente a la etapa de inducción y de crecimiento con respecto al tiempo total de formación del hidrato fueron también determinantes en el momento de sacar conclusiones. Los resultados obtenidos son reportados en la Tabla I.
En la primera línea de la tabla se encuentran los tiempos registrados para la formación de hidratos a partir de una solución de THF al 20% v/v sin la presencia de pectina, datos que corresponden
a la Figura 6, y que sirvieron como referencia para realizar la comparación con los demás experimentos.
Con respecto al periodo de inducción, aunque se esperaba tener un tiempo más prolongado con la
adición de pectina, algunos ensayos mostraron resultados adversos, al registrar tiempos menores para la etapa de inducción en comparación con el proceso normal de formación de hidratos de THF sin inhibidor. Igualmente sucedió con respecto al periodo de crecimiento.
Al realizar el análisis comparativo de los resultados obtenidos se pudo establecer cuáles fueron las pectinas con las que se registraron los mayores tiempos para los periodos de inducción y de crecimiento en la formación de los hidratos. Los resultados más representativos se muestran en la Figura 8.
Cuando se utilizó una concentración de 0,1% de pectina de frutos cítricos esterificada se alcanzó el mayor tiempo registrado para el periodo de inducción: 79 min, además de registrar también el tiempo total más prolongado para la formación del hidrato: 143 min (Figura 9)
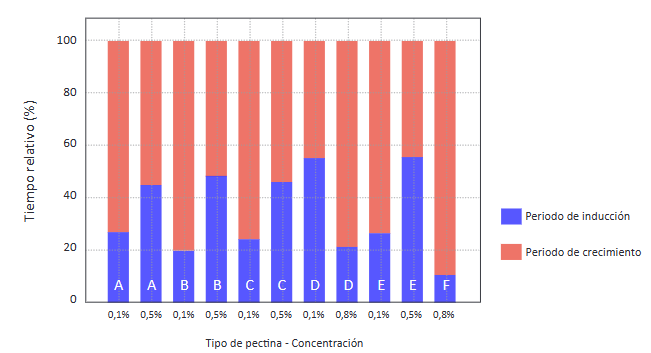
El mayor tiempo relativo de inducción se obtuvo con la utilización de una concentración de 0,5% de pectina de frutos cítricos esterificada con sal de potasio: 56% del tiempo total de formación del hidrato (Figura 10).
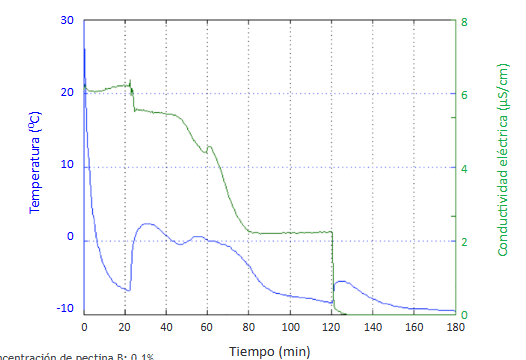
Cuando se utilizó una concentración de 0,1% de pectina de frutos cítricos de bajo índice de metoxilo se alcanzó el mayor tiempo registrado para el periodo de crecimiento: 98 min, aunque su periodo de inducción fue menor con relación al proceso de formación de hidratos de THF sin inhibidor (Figura 11).
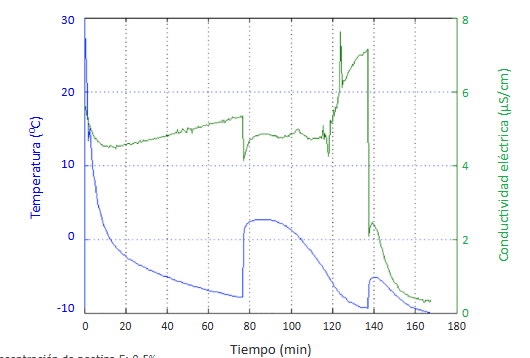
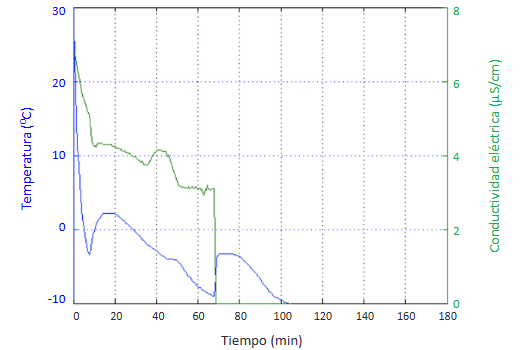
El mayor tiempo relativo de crecimiento se obtuvo con la utilización de una concentración de 0,8% de pectinasa de Aspergillus niger: 88% del tiempo
total de formación del hidrato, pero a su vez este ensayo fue el que registró el menor tiempo de inducción (Figura 12).
C. Disociación de hidratos de THF por adición de pectina
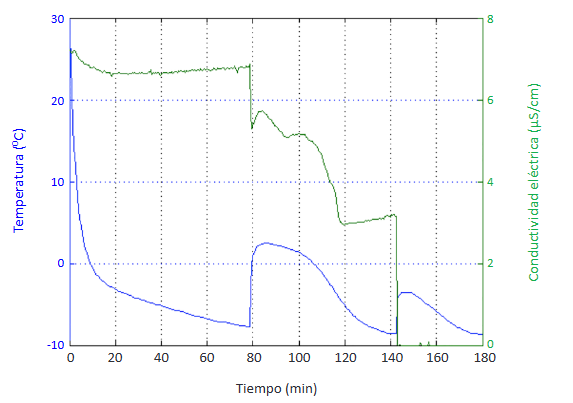
Con el propósito de revertir el proceso de formación de hidratos de THF una vez superado el periodo de inducción, se realizaron dos ensayos en los que se adicionó la pectina 3 minutos después de la inducción. Para ello, se escogieron las pectinas con los resultados más representativos obtenidos anteriormente, 0,1% de pectina de frutos cítricos de bajo índice de metoxilo y 0,1% de pectina de frutos cítricos esterificada, se disolvieron en un volumen de agua equivalente al 10% del volumen de la solución formadora de hidratos y se agregaron al enfriador.
Para ambos ensayos, la temperatura y la conductividad eléctrica continuaron descendiendo luego de agregar la pectina, sin manifestarse ningún cambio que evidenciara su acción inhibidora, hasta alcanzar la congelación de toda la masa de hidratos.
En ninguno de los casos se observó el cambio en las curvas de temperatura y conductividad eléctrica que correspondía al final del periodo de crecimiento del hidrato.
D. Uso de pectina como inhibidor en la formación de hidratos de gas
La inhibición de hidratos con sustancias químicas es el método más utilizado en el procesamiento y transporte de gas natural y el desarrollo de inhibidores de hidratos alternativos, de bajo costo y ambientalmente aceptables, como lo sería la pectina, es un reto para la industria de producción de gas natural [10] y [27].
Los inhibidores cinéticos tienden a disminuir la velocidad del proceso de inducción y a retrasar la formación y crecimiento de los cristales de hidrato, pero no pueden prevenir por completo la nucleación
[6] y [27]. Es por esto que el comportamiento de las pectinas como inhibidores está condicionado más que todo por el tiempo de exposición de la tubería propensa a formar hidratos a condiciones favorables para ello. Además, la inyección de pectina estaría acompañada de un aumento en la cantidad de agua dentro la tubería, factor que favorece la formación de hidratos, por tanto, la dispersión y completa disolución de la pectina se convierte en una operación de importancia tal que puede llegar a incidir en los resultados generales del proceso.
V. CONCLUSIONES
La variación de la conductividad eléctrica y de la temperatura fueron los parámetros que permitieron identificar las etapas de formación de los hi dratos, el periodo de inducción y de crecimiento, con lo que se pudo establecer y comparar los tiempos tomados para cada periodo en cada experimento realizado.
Cuando se formaron hidratos a partir de soluciones de THF al 20% v/v se pudo distinguir con claridad cada una de las etapas de formación de los hidratos.
Cuando se agregó pectina a la solución formadora de hidratos, y se utilizó una concentración de 0,1% de pectina de frutos cítricos esterificada, se registró el mayor tiempo para el periodo de inducción.
Cuando se agregó pectina a la solución formadora de hidratos, y se utilizó una concentración de 0,1% de pectina de frutos cítricos de bajo índice de metoxilo, se registró el mayor tiempo para el periodo de crecimiento.
La adición de pectina no evitó por completo la formación de los hidratos ya que, en algún momento determinado, todos los experimentos realizados terminaron con la aglomeración de los cristales de hidrato, hecho que se evidenció mediante la observación de la solución formadora de hidratos y la tendencia de los valores registrados para la temperatura y la conductividad eléctrica.
Al agregarse pectina, luego de la etapa de inducción del hidrato, no se manifestó ningún cambio que evidenciara su acción inhibidora, ni tampoco pudo distinguirse con claridad el final de la etapa de crecimiento mediante el análisis de las variaciones de temperatura y de conductividad eléctrica.
Las pectinas comerciales que mostraron resultados positivos como inhibidores en la formación de hidratos de THF podrían también tener el potencial de inhibir la formación de hidratos de gas natural.
VI. NOMENCLATURA
mL: mililitros
min: minutos
THF: Tetrahidrofurano
% v/v: Porcentaje volumen a volumen μS/cm: Micro Siemens por centímetro
Estudio comparativo del comportamiento de algunas pectinas comerciales como inhibidores en la formación de hidratos de tetrahidrofurano
[1] Z. R. Chong, S. H. B. Yang, P. Babu, P. Linga, and X. S. Li, “Review of natural gas hydrates as an energy resource: Prospects and challenges,” Applied energy, n°. 162, pp. 1633-1652, 2016
[2] S. Y. Lee and G. D. Holder, “Methane hydra- tes potential as a future energy source,” Fuel processing technology, vol. 71, n°. 1-3, pp. 181-186, 2001.
[3] F. Li, Q. Yuan, T. Li, Z. Li, C. Sun, and G. Chen, “A review: Enhanced recovery of natural gas hydrate reservoirs,” Chinese Journal of Chemical Engineering, vol. 27, n°. 9, pp. 2062-2073, 2019.
[4] X. S. Li, C. G. Xu, Y. Zhang, X. K. Ruan, G. Li, and Y. Wang, “Investigation into gas pro- duction from natural gas hydrate: A review,” Applied Energy, n°. 172, pp. 286-322, 2016.
[5] Y. Liang, Y. Tan, Y. Luo, Y. Zhang, and B. Li, Progress and challenges on gas production from natural gas hydrate-bearing sediment,” Journal of Cleaner Production, vol. 261, 121061, 2020.
[6] D. Chillón, Estudio del Método de Detección de Hidratos de Tetrahidrofurano y Compara- ción de la Eficiencia de Inhibidor de Química Verde Respecto al Inhibidor Convencional Me- tanol, tesis de grado, Ingeniería Química, Uni- versidad Central de Venezuela, Caracas, 2011.
[7] G. D. Holder, L. P. Mokka, and R. P. Warzinski, “Formation of gas hydrates from single-phase aqueous solutions,” Chemical engineering science, vol. 56, n°. 24, pp. 6897-6903, 2001.
[8] S. Al-Adel, J. A. Dick, R. El-Ghafari, and P. Servio, “The effect of biological and polymeric inhibitors on methane gas hydrate growth kinetics,” Fluid Phase Equilibria, vol. 267, n°. 1, pp. 92-98, 2008.
[9] C. B. Bavoh, B. Lal, H. Osei, K. M. Sabil, and H. Mukhtar, “A review on the role of amino acids in gas hydrate inhibition, CO2 capture and sequestration, and natural gas storage,” Journal of Natural Gas Science and Engineering, n°. 64, pp. 52-71, 2019.
[10] W. Ke, and D. Chen, “A short review on natural gas hydrate, kinetic hydrate inhibitors and inhibitor synergists,” Chinese Journal of Chemical Engineering, vol. 27, n°. 9, pp. 2049-2061, 2019.
[11] D. Dugarte, Determinación del Método y las Condiciones de Operación Óptimas para la Extracción de la Pectina Contenida en la Cáscara de Mango, así como su Aplicación para la Inhibición de Hidratos de Tetrahidro- furano, tesis de grado, Ingeniería Química, Universidad Central de Venezuela, Caracas., 2011.
[12] M. Asadi, K. Peyvandi, F. Varaminian, and Z. Mokarian, “Investigation of THF hydrate formation kinetics: Experimental measurements of volume changes,” Journal of Molecular Liquids, vol. 290, 111200, 2019.
[13] E. D. Sloan Jr., C. A. Koh, and C. Koh, Clathra- te hydrates of natural gases. Boca Raton: CRC press, 2007.
[14] S. Fang, X. Zhang, J. Zhang, C. Chang, P. Li, and J. Bai, “Evaluation on the natural gas hydrate formation process,” Chinese Journal of Chemical Engineering, vol. 28, n°. 3, pp. 881-888, 2020.
[15] U. Karaaslan, E. Uluneye, and M. Parlaktuna, “Effect of an anionic surfactant on different type of hydrate structures,” Journal of Petroleum Science and Engineering, vol. 35, n°. 1-2, pp. 49-57, 2002.
[16] E. M. Freer, M. S. Selim, & E. D. Sloan Jr., “Methane hydrate film growth kinetics,” Fluid Phase Equilibria, vol. 185, n°. 1-2, pp. 65-75, 2001
[17] R. Larsen, C. A. Knight, and E. D. Knight, “Cla- thrate hydrate growth and inhibition,” Fluid Phase Equilibria, n°. 150, pp. 353-360, 1998.
[18] G. J. Chen, C. Y. Sun, and T. M. Guo, “Modelling of the formation conditions of structure-H hydrates,” Fluid phase equilibria, vol. 204 n°. 1, pp. 107-117, 2003.
[19] C.A.Koh,R.E.Westacott,W.Zhang,K.Hirachand, J. L. Creek, & A. K. Soper, “Mechanisms of gas hydrate formation and inhibition,” Fluid Phase Equilibria, n°. 194, pp. 143-151, 2002.
[20] K. A. Udachin, C. I. Ratcliffe and J. A. Rip- meester, “Single crystal diffraction studies of structure I, II and H hydrates: structure, cage occupancy and composition,” Journal of Su- pramolecular Chemistry, vol. 2, n°. 4-5, pp. 405-408, 2002.
[21] S. Shahnazar and N. Hasan, “Gas hydrate for- mation condition: Review on experimental and modeling approaches”, Fluid Phase Equilibria, n°. 379, pp. 72-85, 2014.
[22] D. Kashchiev and A. Firoozabadi, “Induction time in crystallization of gas hydrates,” Jour- nal of crystal growth, vol. 250, n°. 3-4, pp. 499-515, 2003.
[23] M. Yang, J. Zhao, J. N. Zheng, and Y. Song, “Hydrate reformation characteristics in natu- ral gas hydrate dissociation process: A review,” Applied Energy, vol. 256, 113878, 2019.
[24] B. Chen, H. Dong, H. Sun, P. Wang, and L. Yang, “Effect of a weak electric field on THF hydrate formation: Induction time and morphology,” Journal of Petroleum Science and Engineering, vol. 194, 107486, 2020.
[25] V. Nardone, M. Müller, A. Bouza, Y. Sánchez, and J. Montbrun, “Evaluación de modelos em- píricos para la predicción de hidratos de gas natural,” Revista de la facultad de Ingeniería (UCV, Caracas), vol. 24, n°. 3, pp. 21-31, 2009.
[26] J.Y.Lee,T.S.Yun,J.C.Santamarina,and C.Ruppel, “Observations related to tetrahydrofuran and methane hydrates for laboratory studies of hydrate-bearing sediments,” Geochemistry, Geophysics, Geosystems, vol. 8, n°. 6, pp. 1-10, 2007
[27] Q. Nasir, H. Suleman, and Y. A. Elsheikh, “A review on the role and impact of various ad- ditives as promoters/inhibitors for gas hydrate formation,” Journal of Natural Gas Science and Engineering, vol. 76, 103211, 2020.
[28] J. Devia, Proceso para producir pectinas cítri- cas. Medellín: Universidad Eafit, 2003.
[29] J. Piza and M. Koss, “Estudio preliminar de la obtención y caracterización de pectinas a par- tir de residuos de naranjas de la variedad crio- lla del cantón de Acosta,” Ingeniería y ciencia química, vol. 9, n°. 2, pp. 49-52, 1984.
[30] R. Wang, R. Li, L. Zhang, J. Sun, H. Sun, and X. Shi, “Kinetic mechanism of hydrophilic amino acid inhibiting the formation of tetrahydrofu- ran (THF) hydrate,” Natural Gas Industry B., vol. 7, n°. 2, pp. 184-189, 2020

